摘要:研究小組揭示了,當細胞的DNA受損時,一種以前未知的機制會引發細胞的炎癥免疫反應。
來自加州大學爾灣分校的一個研究小組揭示了一種以前未知的機制,當細胞DNA受損時,這種機制會觸發細胞的炎癥免疫反應。這一發現加深了對一種新型細胞信號傳導的理解,可能會導致更有效的癌癥治療。
這項研究今天在線發表在《自然結構與分子生物學》雜志上,發現紫外線照射或某些化療藥物會在細胞受損過度而無法正確修復時激活一種特定的反應,從而防止細胞癌變。
 圖1 ATM和IRAK1協調兩種不同的NF-κB激活機制以應對DNA損傷
圖1 ATM和IRAK1協調兩種不同的NF-κB激活機制以應對DNA損傷“這一發現可能對癌癥治療產生重大影響,”通訊作者、加州大學歐文分校生物化學副教授Rémi Buisson說。“了解不同的癌細胞對DNA損傷的反應可能會導致更有針對性和更有效的治療方法,有可能減少負面副作用,提高患者的生活質量。”
科學家們早就知道,當兩條DNA鏈都斷裂時,ATM酶會觸發細胞內NF-κB蛋白的激活,導致炎癥信號的產生。在這項由博士后Elodie Bournique牽頭,研究生Ambrocio Sanchez協助的研究中,研究表明,當由于紫外線照射或化療藥物(如放線菌素D或喜樹堿)治療導致DNA損傷時,IRAK1酶誘導NF-κB發出信號以招募免疫細胞。
團隊成員開發了一種先進的成像技術來分析NF-κB是如何在細胞水平上被調節的。研究人員能夠在單細胞水平上精確測量細胞對受損DNA的反應,并觀察到NF-κB活化的新途徑。他們發現,在特定類型的損傷后,細胞釋放IL-1α蛋白。它不作用于細胞本身,而是移動到鄰近的細胞,在那里它觸發IRAK1蛋白,然后啟動NF-κB炎癥反應。
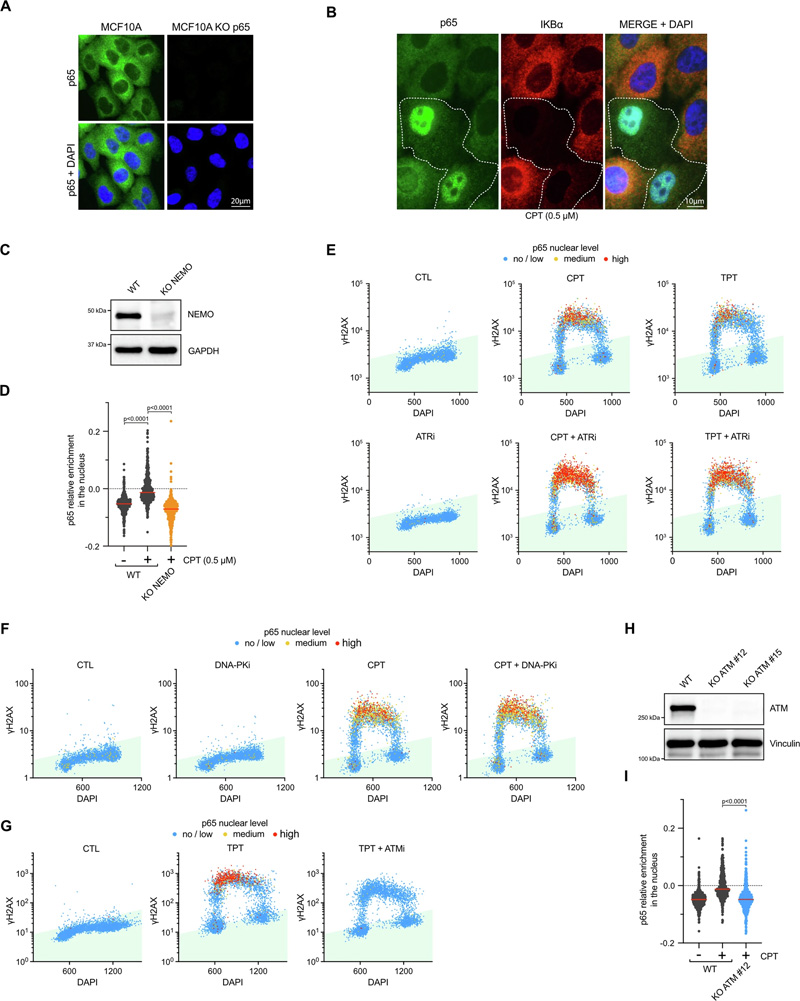
圖2 拓撲異構酶1抑制劑激活NF-κB
“我們的發現將幫助我們更好地理解用于治療患者并導致DNA損傷的某些類型的化療藥物的后果。我們發現,在免疫過程中起作用的IL-1α和IRAK1蛋白在不同的癌細胞類型中差異很大。Buisson說,這表明并非所有患者對治療的反應都是一樣的。“通過提前評估這些蛋白質水平,醫生可能能夠根據個別患者的需求定制個性化治療,以提高成功率。”
研究人員將繼續他們的工作,在缺乏新途徑中涉及的特定因素的小鼠模型上測試他們的發現。
參考資料
[1] ATM and IRAK1 orchestrate two distinct mechanisms of NF-κB activation in response to DNA damage
摘要:研究小組揭示了,當細胞的DNA受損時,一種以前未知的機制會引發細胞的炎癥免疫反應。
來自加州大學爾灣分校的一個研究小組揭示了一種以前未知的機制,當細胞DNA受損時,這種機制會觸發細胞的炎癥免疫反應。這一發現加深了對一種新型細胞信號傳導的理解,可能會導致更有效的癌癥治療。
這項研究今天在線發表在《自然結構與分子生物學》雜志上,發現紫外線照射或某些化療藥物會在細胞受損過度而無法正確修復時激活一種特定的反應,從而防止細胞癌變。
 圖1 ATM和IRAK1協調兩種不同的NF-κB激活機制以應對DNA損傷
圖1 ATM和IRAK1協調兩種不同的NF-κB激活機制以應對DNA損傷“這一發現可能對癌癥治療產生重大影響,”通訊作者、加州大學歐文分校生物化學副教授Rémi Buisson說。“了解不同的癌細胞對DNA損傷的反應可能會導致更有針對性和更有效的治療方法,有可能減少負面副作用,提高患者的生活質量。”
科學家們早就知道,當兩條DNA鏈都斷裂時,ATM酶會觸發細胞內NF-κB蛋白的激活,導致炎癥信號的產生。在這項由博士后Elodie Bournique牽頭,研究生Ambrocio Sanchez協助的研究中,研究表明,當由于紫外線照射或化療藥物(如放線菌素D或喜樹堿)治療導致DNA損傷時,IRAK1酶誘導NF-κB發出信號以招募免疫細胞。
團隊成員開發了一種先進的成像技術來分析NF-κB是如何在細胞水平上被調節的。研究人員能夠在單細胞水平上精確測量細胞對受損DNA的反應,并觀察到NF-κB活化的新途徑。他們發現,在特定類型的損傷后,細胞釋放IL-1α蛋白。它不作用于細胞本身,而是移動到鄰近的細胞,在那里它觸發IRAK1蛋白,然后啟動NF-κB炎癥反應。

圖2 拓撲異構酶1抑制劑激活NF-κB
“我們的發現將幫助我們更好地理解用于治療患者并導致DNA損傷的某些類型的化療藥物的后果。我們發現,在免疫過程中起作用的IL-1α和IRAK1蛋白在不同的癌細胞類型中差異很大。Buisson說,這表明并非所有患者對治療的反應都是一樣的。“通過提前評估這些蛋白質水平,醫生可能能夠根據個別患者的需求定制個性化治療,以提高成功率。”
研究人員將繼續他們的工作,在缺乏新途徑中涉及的特定因素的小鼠模型上測試他們的發現。
參考資料
[1] ATM and IRAK1 orchestrate two distinct mechanisms of NF-κB activation in response to DNA damage



