摘要:在慢性淋巴細(xì)胞性白血病等血癌中,免疫系統(tǒng)的B細(xì)胞不受控制地繁殖。
近日,德國(guó)維爾茨堡大學(xué)生物中心生物技術(shù)與生物物理學(xué)系的研究人員在Science期刊上發(fā)表了一篇具有重要意義的論文,這項(xiàng)工作由歐洲研究委員會(huì)、德國(guó)聯(lián)邦教育和研究部以及德國(guó)研究基金會(huì)資助。該研究聚焦于治療性單克隆抗體(mAbs)與CD20分子之間的相互作用機(jī)制。這項(xiàng)研究不僅為理解mAbs如何激活免疫系統(tǒng)以殺死B細(xì)胞提供了關(guān)鍵的分子層面見(jiàn)解,還可能對(duì)改進(jìn)現(xiàn)有mAbs藥物的設(shè)計(jì)和開(kāi)發(fā)產(chǎn)生深遠(yuǎn)影響。
 圖1 用快速體積納米顯微鏡解碼CD20和治療性抗體的分子相互作用
圖1 用快速體積納米顯微鏡解碼CD20和治療性抗體的分子相互作用背景
在過(guò)去30年里,治療性單克隆抗體作為抗癌藥物取得了巨大成功。它們通過(guò)特異性結(jié)合目標(biāo)抗原來(lái)誘導(dǎo)細(xì)胞毒性,促進(jìn)免疫反應(yīng),如抗體依賴(lài)性細(xì)胞毒性(ADCC)和補(bǔ)體依賴(lài)性細(xì)胞毒性(CDC)。CD20是一種在大多數(shù)B細(xì)胞表面表達(dá)的受體,利妥昔單抗(RTX)是首個(gè)獲批的抗CD20治療性mAb,用于治療B細(xì)胞惡性腫瘤和自身免疫性疾病。此外,還有人源化mAb奧法木單抗(OFA)和奧濱尤妥珠單抗(OBZ)等。這些mAbs與B細(xì)胞結(jié)合后,會(huì)改變CD20在膜上的納米尺度組織,激活細(xì)胞毒性途徑。然而,目前對(duì)于mAbs的結(jié)合機(jī)制以及結(jié)合誘導(dǎo)的內(nèi)源性CD20在膜上的重組如何激活免疫系統(tǒng)殺死B細(xì)胞的分子細(xì)節(jié)知之甚少。早期有跡象表明CD20可被RTX串聯(lián),但相關(guān)實(shí)驗(yàn)是在非生理?xiàng)l件下進(jìn)行的體外實(shí)驗(yàn)。為了破解B細(xì)胞上內(nèi)源性CD20與治療性mAbs之間的分子相互作用,需要能夠提供高時(shí)空分辨率的三維(3D)體積超分辨率熒光成像方法。
JMU生物中心的Markus Sauer教授說(shuō):“在慢性淋巴細(xì)胞白血病等血癌中,免疫系統(tǒng)的B細(xì)胞不受控制地繁殖。一種治療方法是用定制抗體在B細(xì)胞表面標(biāo)記CD20蛋白。這會(huì)引發(fā)一系列的免疫反應(yīng),最終導(dǎo)致癌細(xì)胞的毀滅。這種免疫治療抗體已經(jīng)用于治療腫瘤疾病30年了。盡管這對(duì)治療的成功至關(guān)重要,但我們?nèi)匀粚?duì)抗體如何與CD20結(jié)合以及隨后的反應(yīng)如何發(fā)生的細(xì)節(jié)知之甚少。”
追蹤抗體有效性
這種情況現(xiàn)在可能會(huì)改變:由JMU生物物理學(xué)家領(lǐng)導(dǎo)的一個(gè)團(tuán)隊(duì)開(kāi)發(fā)了一種新的超分辨率顯微方法。這使得首次在具有分子分辨率的3D中研究治療性抗體與腫瘤細(xì)胞靶分子的相互作用成為可能。Markus Sauer說(shuō):“我們現(xiàn)在可以觀(guān)察到抗體的工作效率,從而為改進(jìn)治療方法的發(fā)展做出貢獻(xiàn)。”這種新的顯微方法被稱(chēng)為L(zhǎng)LS-TDI-DNA-PAINT。在科學(xué)雜志《Science》上,第一作者Arindam Ghosh博士和Markus Sauer的主席團(tuán)隊(duì)描述了新開(kāi)發(fā)的技術(shù)如何工作,以及已經(jīng)獲得的發(fā)現(xiàn)。來(lái)自維爾茨堡大學(xué)附屬醫(yī)院第二醫(yī)學(xué)診所的Thomas Nerreter博士和Martin kort教授也參與了這項(xiàng)研究。
材料方法與關(guān)鍵技術(shù)路線(xiàn)
研究人員引入了一種速度優(yōu)化的基于DNA的點(diǎn)累積成像納米拓?fù)洌―NA-PAINT)變體。其核心思想是利用常規(guī)的DNA-PAINT成像器,這些成像器末端標(biāo)記有兩個(gè)相同的熒光團(tuán),在未結(jié)合狀態(tài)下形成非熒光H-二聚體。這使得能夠使用更高濃度的成像器,從而比經(jīng)典DNA-PAINT實(shí)現(xiàn)約15倍更快的二維(2D)成像。為了實(shí)現(xiàn)快速的全細(xì)胞三維成像,研究人員將雙染料成像器DNA-PAINT(TDI-DNA-PAINT)與晶格光片(LLS)顯微鏡相結(jié)合。此外,他們還利用LLS成像技術(shù)來(lái)闡明mAbs與CD20在活B細(xì)胞中實(shí)時(shí)的結(jié)合相互作用,實(shí)現(xiàn)了四維成像。
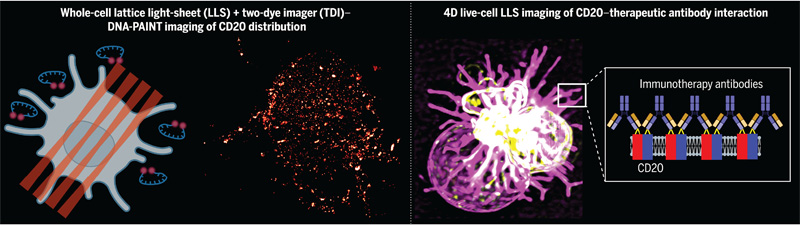
圖2 CD20和治療性單克隆抗體的分子相互作用
研究結(jié)果
mAb-CD20復(fù)合物分布成像
通過(guò)應(yīng)用二維TDI-DNA-PAINT,研究人員對(duì)貼壁B細(xì)胞基底膜上的mAb-CD20復(fù)合物分布進(jìn)行了成像,識(shí)別出由微絨毛聚集的CD20受體串聯(lián)形成的絲狀排列,這些受體夾在細(xì)胞和蓋玻片之間。為了避免表面誘導(dǎo)的偽影,他們使用三維LLS TDI-DNA-PAINT驗(yàn)證了結(jié)果。由于TDI-DNA-PAINT允許使用顯著更高濃度的成像探針,全細(xì)胞成像僅需幾小時(shí)即可完成。
mAbs對(duì)CD20的交聯(lián)作用
研究發(fā)現(xiàn),CD20不僅被I型mAbs RTX和OFA交聯(lián),而且在較高濃度下也被II型mAb OBZ交聯(lián),從而推翻了目前對(duì)治療性mAbs的分類(lèi)。此外,研究人員還證明了I型和II型mAbs都能誘導(dǎo)B細(xì)胞極化,并使CD20在微絨毛上積累,這些微絨毛通過(guò)mAbs的結(jié)合和串聯(lián)得以穩(wěn)定,且不同mAbs的結(jié)合和串聯(lián)效率不同。
結(jié)論與討論
本研究通過(guò)TDI-DNA-PAINT技術(shù),結(jié)合LLS顯微鏡實(shí)現(xiàn)了快速全細(xì)胞成像,清晰地揭示了B細(xì)胞上內(nèi)源性CD20與三種不同治療性mAbs之間的分子相互作用。研究人員明確識(shí)別出I型和II型mAbs都能交聯(lián)并串聯(lián)CD20,形成不同幾何形狀的復(fù)合物,這無(wú)疑表明目前的mAbs分類(lèi)是站不住腳的。鑒于CD20在微絨毛上強(qiáng)烈表達(dá),且mAb結(jié)合會(huì)導(dǎo)致細(xì)胞突起處Fc片段局部高濃度聚集,可以推測(cè)這些CD20-mAb寡聚結(jié)構(gòu)會(huì)激活補(bǔ)體系統(tǒng)。活細(xì)胞成像顯示,在I型和II型mAb結(jié)合下,B細(xì)胞以濃度依賴(lài)性方式發(fā)生極化,細(xì)胞一側(cè)出現(xiàn)穩(wěn)定的微絨毛突起,且微絨毛的突起長(zhǎng)度也受到所用mAb濃度的強(qiáng)烈控制。這些類(lèi)似“刺猬”的細(xì)胞可能會(huì)很好地觸發(fā)巨噬細(xì)胞和自然殺傷細(xì)胞。
這項(xiàng)研究的重要性在于,它不僅為理解治療性mAbs的作用機(jī)制提供了新的視角,還可能為開(kāi)發(fā)更有效的mAbs藥物提供理論依據(jù)。通過(guò)深入了解mAbs與CD20的相互作用細(xì)節(jié),未來(lái)有望設(shè)計(jì)出更具針對(duì)性、更高效的治療方案,以更好地利用人體自身的免疫系統(tǒng)來(lái)對(duì)抗B細(xì)胞相關(guān)的疾病,這對(duì)于提高患者的治療效果和生存率具有重大意義。
接下來(lái)會(huì)發(fā)生什么?Arindam Ghosh博士說(shuō),以前將治療性抗體分為I型和II型的做法不能再維持下去了。到目前為止,研究已經(jīng)假設(shè)I型治療性抗體的作用機(jī)制與II型抗體不同。然而,新研究反駁了這一點(diǎn)。JMU的研究人員說(shuō):“刺猬的形狀使B細(xì)胞看起來(lái)好像它們想與另一個(gè)細(xì)胞形成免疫突觸。”可以想象,經(jīng)過(guò)處理的B細(xì)胞以這種方式激活免疫系統(tǒng)的巨噬細(xì)胞和自然殺傷細(xì)胞。研究小組現(xiàn)在將在進(jìn)一步的研究中澄清這一假設(shè)是否正確。
參考資料
[1] Decoding the molecular interplay of CD20 and therapeutic antibodies with fast volumetric nanoscopy
摘要:在慢性淋巴細(xì)胞性白血病等血癌中,免疫系統(tǒng)的B細(xì)胞不受控制地繁殖。
近日,德國(guó)維爾茨堡大學(xué)生物中心生物技術(shù)與生物物理學(xué)系的研究人員在Science期刊上發(fā)表了一篇具有重要意義的論文,這項(xiàng)工作由歐洲研究委員會(huì)、德國(guó)聯(lián)邦教育和研究部以及德國(guó)研究基金會(huì)資助。該研究聚焦于治療性單克隆抗體(mAbs)與CD20分子之間的相互作用機(jī)制。這項(xiàng)研究不僅為理解mAbs如何激活免疫系統(tǒng)以殺死B細(xì)胞提供了關(guān)鍵的分子層面見(jiàn)解,還可能對(duì)改進(jìn)現(xiàn)有mAbs藥物的設(shè)計(jì)和開(kāi)發(fā)產(chǎn)生深遠(yuǎn)影響。
 圖1 用快速體積納米顯微鏡解碼CD20和治療性抗體的分子相互作用
圖1 用快速體積納米顯微鏡解碼CD20和治療性抗體的分子相互作用背景
在過(guò)去30年里,治療性單克隆抗體作為抗癌藥物取得了巨大成功。它們通過(guò)特異性結(jié)合目標(biāo)抗原來(lái)誘導(dǎo)細(xì)胞毒性,促進(jìn)免疫反應(yīng),如抗體依賴(lài)性細(xì)胞毒性(ADCC)和補(bǔ)體依賴(lài)性細(xì)胞毒性(CDC)。CD20是一種在大多數(shù)B細(xì)胞表面表達(dá)的受體,利妥昔單抗(RTX)是首個(gè)獲批的抗CD20治療性mAb,用于治療B細(xì)胞惡性腫瘤和自身免疫性疾病。此外,還有人源化mAb奧法木單抗(OFA)和奧濱尤妥珠單抗(OBZ)等。這些mAbs與B細(xì)胞結(jié)合后,會(huì)改變CD20在膜上的納米尺度組織,激活細(xì)胞毒性途徑。然而,目前對(duì)于mAbs的結(jié)合機(jī)制以及結(jié)合誘導(dǎo)的內(nèi)源性CD20在膜上的重組如何激活免疫系統(tǒng)殺死B細(xì)胞的分子細(xì)節(jié)知之甚少。早期有跡象表明CD20可被RTX串聯(lián),但相關(guān)實(shí)驗(yàn)是在非生理?xiàng)l件下進(jìn)行的體外實(shí)驗(yàn)。為了破解B細(xì)胞上內(nèi)源性CD20與治療性mAbs之間的分子相互作用,需要能夠提供高時(shí)空分辨率的三維(3D)體積超分辨率熒光成像方法。
JMU生物中心的Markus Sauer教授說(shuō):“在慢性淋巴細(xì)胞白血病等血癌中,免疫系統(tǒng)的B細(xì)胞不受控制地繁殖。一種治療方法是用定制抗體在B細(xì)胞表面標(biāo)記CD20蛋白。這會(huì)引發(fā)一系列的免疫反應(yīng),最終導(dǎo)致癌細(xì)胞的毀滅。這種免疫治療抗體已經(jīng)用于治療腫瘤疾病30年了。盡管這對(duì)治療的成功至關(guān)重要,但我們?nèi)匀粚?duì)抗體如何與CD20結(jié)合以及隨后的反應(yīng)如何發(fā)生的細(xì)節(jié)知之甚少。”
追蹤抗體有效性
這種情況現(xiàn)在可能會(huì)改變:由JMU生物物理學(xué)家領(lǐng)導(dǎo)的一個(gè)團(tuán)隊(duì)開(kāi)發(fā)了一種新的超分辨率顯微方法。這使得首次在具有分子分辨率的3D中研究治療性抗體與腫瘤細(xì)胞靶分子的相互作用成為可能。Markus Sauer說(shuō):“我們現(xiàn)在可以觀(guān)察到抗體的工作效率,從而為改進(jìn)治療方法的發(fā)展做出貢獻(xiàn)。”這種新的顯微方法被稱(chēng)為L(zhǎng)LS-TDI-DNA-PAINT。在科學(xué)雜志《Science》上,第一作者Arindam Ghosh博士和Markus Sauer的主席團(tuán)隊(duì)描述了新開(kāi)發(fā)的技術(shù)如何工作,以及已經(jīng)獲得的發(fā)現(xiàn)。來(lái)自維爾茨堡大學(xué)附屬醫(yī)院第二醫(yī)學(xué)診所的Thomas Nerreter博士和Martin kort教授也參與了這項(xiàng)研究。
材料方法與關(guān)鍵技術(shù)路線(xiàn)
研究人員引入了一種速度優(yōu)化的基于DNA的點(diǎn)累積成像納米拓?fù)洌―NA-PAINT)變體。其核心思想是利用常規(guī)的DNA-PAINT成像器,這些成像器末端標(biāo)記有兩個(gè)相同的熒光團(tuán),在未結(jié)合狀態(tài)下形成非熒光H-二聚體。這使得能夠使用更高濃度的成像器,從而比經(jīng)典DNA-PAINT實(shí)現(xiàn)約15倍更快的二維(2D)成像。為了實(shí)現(xiàn)快速的全細(xì)胞三維成像,研究人員將雙染料成像器DNA-PAINT(TDI-DNA-PAINT)與晶格光片(LLS)顯微鏡相結(jié)合。此外,他們還利用LLS成像技術(shù)來(lái)闡明mAbs與CD20在活B細(xì)胞中實(shí)時(shí)的結(jié)合相互作用,實(shí)現(xiàn)了四維成像。

圖2 CD20和治療性單克隆抗體的分子相互作用
研究結(jié)果
mAb-CD20復(fù)合物分布成像
通過(guò)應(yīng)用二維TDI-DNA-PAINT,研究人員對(duì)貼壁B細(xì)胞基底膜上的mAb-CD20復(fù)合物分布進(jìn)行了成像,識(shí)別出由微絨毛聚集的CD20受體串聯(lián)形成的絲狀排列,這些受體夾在細(xì)胞和蓋玻片之間。為了避免表面誘導(dǎo)的偽影,他們使用三維LLS TDI-DNA-PAINT驗(yàn)證了結(jié)果。由于TDI-DNA-PAINT允許使用顯著更高濃度的成像探針,全細(xì)胞成像僅需幾小時(shí)即可完成。
mAbs對(duì)CD20的交聯(lián)作用
研究發(fā)現(xiàn),CD20不僅被I型mAbs RTX和OFA交聯(lián),而且在較高濃度下也被II型mAb OBZ交聯(lián),從而推翻了目前對(duì)治療性mAbs的分類(lèi)。此外,研究人員還證明了I型和II型mAbs都能誘導(dǎo)B細(xì)胞極化,并使CD20在微絨毛上積累,這些微絨毛通過(guò)mAbs的結(jié)合和串聯(lián)得以穩(wěn)定,且不同mAbs的結(jié)合和串聯(lián)效率不同。
結(jié)論與討論
本研究通過(guò)TDI-DNA-PAINT技術(shù),結(jié)合LLS顯微鏡實(shí)現(xiàn)了快速全細(xì)胞成像,清晰地揭示了B細(xì)胞上內(nèi)源性CD20與三種不同治療性mAbs之間的分子相互作用。研究人員明確識(shí)別出I型和II型mAbs都能交聯(lián)并串聯(lián)CD20,形成不同幾何形狀的復(fù)合物,這無(wú)疑表明目前的mAbs分類(lèi)是站不住腳的。鑒于CD20在微絨毛上強(qiáng)烈表達(dá),且mAb結(jié)合會(huì)導(dǎo)致細(xì)胞突起處Fc片段局部高濃度聚集,可以推測(cè)這些CD20-mAb寡聚結(jié)構(gòu)會(huì)激活補(bǔ)體系統(tǒng)。活細(xì)胞成像顯示,在I型和II型mAb結(jié)合下,B細(xì)胞以濃度依賴(lài)性方式發(fā)生極化,細(xì)胞一側(cè)出現(xiàn)穩(wěn)定的微絨毛突起,且微絨毛的突起長(zhǎng)度也受到所用mAb濃度的強(qiáng)烈控制。這些類(lèi)似“刺猬”的細(xì)胞可能會(huì)很好地觸發(fā)巨噬細(xì)胞和自然殺傷細(xì)胞。
這項(xiàng)研究的重要性在于,它不僅為理解治療性mAbs的作用機(jī)制提供了新的視角,還可能為開(kāi)發(fā)更有效的mAbs藥物提供理論依據(jù)。通過(guò)深入了解mAbs與CD20的相互作用細(xì)節(jié),未來(lái)有望設(shè)計(jì)出更具針對(duì)性、更高效的治療方案,以更好地利用人體自身的免疫系統(tǒng)來(lái)對(duì)抗B細(xì)胞相關(guān)的疾病,這對(duì)于提高患者的治療效果和生存率具有重大意義。
接下來(lái)會(huì)發(fā)生什么?Arindam Ghosh博士說(shuō),以前將治療性抗體分為I型和II型的做法不能再維持下去了。到目前為止,研究已經(jīng)假設(shè)I型治療性抗體的作用機(jī)制與II型抗體不同。然而,新研究反駁了這一點(diǎn)。JMU的研究人員說(shuō):“刺猬的形狀使B細(xì)胞看起來(lái)好像它們想與另一個(gè)細(xì)胞形成免疫突觸。”可以想象,經(jīng)過(guò)處理的B細(xì)胞以這種方式激活免疫系統(tǒng)的巨噬細(xì)胞和自然殺傷細(xì)胞。研究小組現(xiàn)在將在進(jìn)一步的研究中澄清這一假設(shè)是否正確。
參考資料
[1] Decoding the molecular interplay of CD20 and therapeutic antibodies with fast volumetric nanoscopy



