摘要:凱斯西儲大學(xué)醫(yī)學(xué)院的研究人員發(fā)現(xiàn)了特定的蛋白質(zhì)區(qū)域如何導(dǎo)致乳腺癌。
來自美國凱斯西儲大學(xué)(Case Western Reserve University)的研究人員在國際頂級學(xué)術(shù)期刊《Nature》上發(fā)表了一篇題為《The sequence–structure–function relationship of intrinsic ERα disorder》的研究論文。該研究深入探討了雌激素受體α(ERα)的內(nèi)在無序性與其功能之間的關(guān)系,這對于理解乳腺癌的發(fā)病機(jī)制以及開發(fā)新的治療策略具有重要意義。該研究不僅揭示了ERα在分子水平上的復(fù)雜調(diào)控機(jī)制,還為未來的藥物研發(fā)提供了新的靶點(diǎn)和理論基礎(chǔ)。
 圖1 內(nèi)源性ERα障礙的序列-結(jié)構(gòu)-功能關(guān)系
圖1 內(nèi)源性ERα障礙的序列-結(jié)構(gòu)-功能關(guān)系本研究聚焦于雌激素受體α(ERα),特別是其N端轉(zhuǎn)錄激活域(NTD)的Ser118磷酸化對ERα活性的影響。研究發(fā)現(xiàn),Ser118的磷酸化通過破壞芳香族氨基酸簇之間的疏水相互作用,引發(fā)ERα-NTD的構(gòu)象變化,進(jìn)而影響ERα介導(dǎo)的轉(zhuǎn)錄活性。這一發(fā)現(xiàn)不僅闡明了磷酸化在轉(zhuǎn)錄因子功能中的調(diào)控作用,還為開發(fā)針對ERα-NTD的直接靶向治療提供了可能。
乳腺癌是全球女性癌癥相關(guān)死亡的首要原因,其中大多數(shù)為雌激素受體陽性(ER+)。Ser118的磷酸化使ER能夠在無配體的情況下被激活,這一過程在乳腺癌的治療抵抗中起著關(guān)鍵作用。盡管CDK7抑制劑在臨床試驗(yàn)中顯示出潛力,但磷酸化驅(qū)動激活的機(jī)制尚不清楚。本研究旨在揭示Ser118磷酸化如何通過影響ERα-NTD的構(gòu)象來調(diào)節(jié)ERα的活性。
研究人員采用了多種生物物理技術(shù),包括尺寸排阻色譜-小角X射線散射(SEC-SAXS)和核磁共振(NMR)光譜學(xué),來表征ERα-NTD的生物物理特性。通過這些技術(shù),研究人員能夠精確測量ERα-NTD的尺寸參數(shù),并分析其結(jié)構(gòu)無序性。此外,研究人員還利用了paramagnetic relaxation enhancement (PRE) 測量來研究氨基酸簇之間的相互作用,并通過體外蛋白磷酸化實(shí)驗(yàn)來研究Ser118磷酸化對ERα-NTD構(gòu)象的影響。
氨基酸簇的殘基結(jié)構(gòu)
通過SEC-SAXS和NMR分析,研究人員發(fā)現(xiàn)ERα-NTD具有特定的生物物理特性,包括兩個具有限制性主鏈流動性的區(qū)域(簇I和簇II),這些區(qū)域?qū)?yīng)于殘基結(jié)構(gòu),解釋了SEC-SAXS數(shù)據(jù)中觀察到的緊湊構(gòu)象。
疏水芳香簇
通過PRE測量發(fā)現(xiàn),簇I和簇II之間的相互作用表明殘基結(jié)構(gòu)起源于芳香氨基酸簇之間的特定疏水相互作用,這些相互作用橋接了這些富含芳香族的區(qū)域。
pSer118驅(qū)動簇分離
研究發(fā)現(xiàn),pSer118通過增加簇I和簇II之間的分離來觸發(fā)ERα-NTD的構(gòu)象變化,同時保持局部簇的完整性。這一發(fā)現(xiàn)表明,磷酸化通過增加簇分離來促進(jìn)ERα-NTD的擴(kuò)張。
疏水破壞簇相互作用
疏水破壞作為主要機(jī)制,包括非離子洗滌劑DDM的使用、Ser118附近的丙氨酸替代以及簇I中的丙氨酸突變,實(shí)驗(yàn)表明疏水相互作用的破壞是結(jié)構(gòu)變化的主要驅(qū)動力。
疏水恢復(fù)ER功能
研究人員比較了磷酸化缺陷(S118A)和磷酸模擬(S118D)突變,發(fā)現(xiàn)S118D表現(xiàn)出比S118A更強(qiáng)的轉(zhuǎn)錄活性。此外,S118A/F120A和S118A/L121A雙突變恢復(fù)了S118A受損的轉(zhuǎn)錄功能,表明疏水相互作用的破壞可以模擬磷酸化效應(yīng),恢復(fù)功能缺陷。
疏水突變調(diào)節(jié)輔因子相互作用和細(xì)胞生長
pSer118和F120A顯著減少了ERα-NTD與TIF2-QRD的相互作用。在TFF1啟動子上,S118A增強(qiáng)了TIF2的募集,而S118D和疏水突變逆轉(zhuǎn)了這一效應(yīng),同時保持了與WT類似的啟動子結(jié)合。這些結(jié)果表明,ERα-NTD的疏水簇調(diào)節(jié)輔因子相互作用和轉(zhuǎn)錄活性。
細(xì)胞生長的表型恢復(fù)
最后,研究人員進(jìn)一步探討了F120A和L121A突變對MCF7細(xì)胞生長和集落形成的影響。S118A未能促進(jìn)生長,而S118D的生長促進(jìn)能力與WT ER相當(dāng)或更高。F120A或L121A與S118A的組合恢復(fù)了與WT和S118D相當(dāng)?shù)纳L促進(jìn)能力。此外,Y52A/Y54A和Y60A/F62A突變也恢復(fù)了S118A受損的細(xì)胞生長和集落形成,支持了疏水破壞效應(yīng)在兩個簇中的作用。
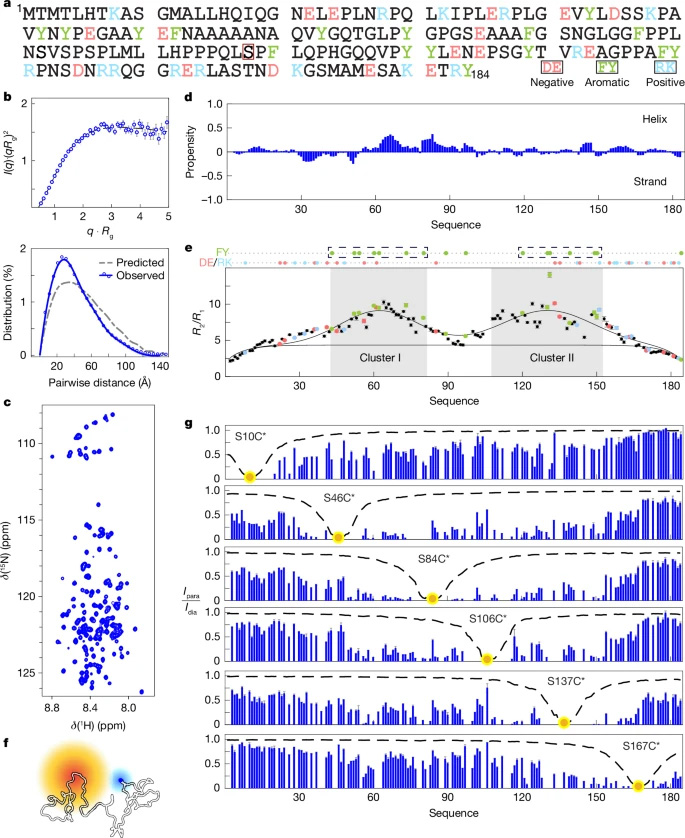
圖2 ER-NTD中的疏水性聚集
研究結(jié)論與討論
本研究揭示了Ser118磷酸化如何通過影響ERα-NTD的疏水簇來調(diào)節(jié)其構(gòu)象和功能。這一發(fā)現(xiàn)不僅擴(kuò)展了我們對磷酸化在轉(zhuǎn)錄因子功能中作用的理解,還為開發(fā)針對ERα-NTD的直接靶向治療提供了新的策略。研究結(jié)果強(qiáng)調(diào)了疏水相互作用在磷酸化誘導(dǎo)的ERα-NTD變化中的主要作用,并為未來的藥物研發(fā)提供了新的靶點(diǎn)。通過破壞疏水相互作用,可以模擬磷酸化效應(yīng),恢復(fù)因磷酸化缺陷導(dǎo)致的功能障礙,這為乳腺癌的治療提供了新的思路和方法。
“就像機(jī)器需要特定的控制來運(yùn)作一樣,像雌激素受體這樣的蛋白質(zhì)控制著細(xì)胞的生長和行為,”凱斯綜合癌癥中心成員、醫(yī)學(xué)院營養(yǎng)學(xué)副教授Sichun Yang說。“我們在雌激素受體中發(fā)現(xiàn)了以前未知的‘分子開關(guān)’,這些開關(guān)雖然靈活,但卻以驚人的精度協(xié)同工作,協(xié)調(diào)細(xì)胞過程。改變蛋白質(zhì)的一部分可以引發(fā)連鎖反應(yīng),影響乳腺癌細(xì)胞的生長。”
雖然可能需要更多的研究來利用他們的發(fā)現(xiàn)來開發(fā)新的治療方法,但這一發(fā)現(xiàn)為科學(xué)家提供了遠(yuǎn)遠(yuǎn)超出乳腺癌的新工具和想法,因?yàn)轭愃频牡鞍踪|(zhì)區(qū)域涉及許多其他疾病。
“不是簡單地關(guān)閉雌激素受體,”Sichun Yang說,“未來的藥物可能會針對這些新發(fā)現(xiàn)的開關(guān)而設(shè)計(jì),為控制蛋白質(zhì)的工作方式提供新的方法。”
研究小組使用來自阿貢國家實(shí)驗(yàn)室先進(jìn)光子源和國家同步加速器光源II的小角度x射線散射和核磁共振波譜工具對蛋白質(zhì)開關(guān)進(jìn)行了非常詳細(xì)的研究。這項(xiàng)合作包括來自亞利桑那州立大學(xué)和俄亥俄州立大學(xué)的研究人員。美國國立衛(wèi)生研究院(National Institutes of Health)、美國癌癥協(xié)會(American Cancer Society)和玫琳凱愛施基金會(Mary Kay Ash Foundation)也提供了額外的支持。
“Yang的工作強(qiáng)調(diào)了利用尖端技術(shù)和團(tuán)隊(duì)合作來回答重大科學(xué)問題的重要性,”醫(yī)學(xué)院蛋白質(zhì)組學(xué)和生物信息學(xué)中心主任Mark Chance說。“這些國家設(shè)施使我們能夠取得突破,推動新的癌癥治療方法。”
參考資料
[1] The sequence–structure–function relationship of intrinsic ERα disorder
摘要:凱斯西儲大學(xué)醫(yī)學(xué)院的研究人員發(fā)現(xiàn)了特定的蛋白質(zhì)區(qū)域如何導(dǎo)致乳腺癌。
來自美國凱斯西儲大學(xué)(Case Western Reserve University)的研究人員在國際頂級學(xué)術(shù)期刊《Nature》上發(fā)表了一篇題為《The sequence–structure–function relationship of intrinsic ERα disorder》的研究論文。該研究深入探討了雌激素受體α(ERα)的內(nèi)在無序性與其功能之間的關(guān)系,這對于理解乳腺癌的發(fā)病機(jī)制以及開發(fā)新的治療策略具有重要意義。該研究不僅揭示了ERα在分子水平上的復(fù)雜調(diào)控機(jī)制,還為未來的藥物研發(fā)提供了新的靶點(diǎn)和理論基礎(chǔ)。
 圖1 內(nèi)源性ERα障礙的序列-結(jié)構(gòu)-功能關(guān)系
圖1 內(nèi)源性ERα障礙的序列-結(jié)構(gòu)-功能關(guān)系本研究聚焦于雌激素受體α(ERα),特別是其N端轉(zhuǎn)錄激活域(NTD)的Ser118磷酸化對ERα活性的影響。研究發(fā)現(xiàn),Ser118的磷酸化通過破壞芳香族氨基酸簇之間的疏水相互作用,引發(fā)ERα-NTD的構(gòu)象變化,進(jìn)而影響ERα介導(dǎo)的轉(zhuǎn)錄活性。這一發(fā)現(xiàn)不僅闡明了磷酸化在轉(zhuǎn)錄因子功能中的調(diào)控作用,還為開發(fā)針對ERα-NTD的直接靶向治療提供了可能。
乳腺癌是全球女性癌癥相關(guān)死亡的首要原因,其中大多數(shù)為雌激素受體陽性(ER+)。Ser118的磷酸化使ER能夠在無配體的情況下被激活,這一過程在乳腺癌的治療抵抗中起著關(guān)鍵作用。盡管CDK7抑制劑在臨床試驗(yàn)中顯示出潛力,但磷酸化驅(qū)動激活的機(jī)制尚不清楚。本研究旨在揭示Ser118磷酸化如何通過影響ERα-NTD的構(gòu)象來調(diào)節(jié)ERα的活性。
研究人員采用了多種生物物理技術(shù),包括尺寸排阻色譜-小角X射線散射(SEC-SAXS)和核磁共振(NMR)光譜學(xué),來表征ERα-NTD的生物物理特性。通過這些技術(shù),研究人員能夠精確測量ERα-NTD的尺寸參數(shù),并分析其結(jié)構(gòu)無序性。此外,研究人員還利用了paramagnetic relaxation enhancement (PRE) 測量來研究氨基酸簇之間的相互作用,并通過體外蛋白磷酸化實(shí)驗(yàn)來研究Ser118磷酸化對ERα-NTD構(gòu)象的影響。
氨基酸簇的殘基結(jié)構(gòu)
通過SEC-SAXS和NMR分析,研究人員發(fā)現(xiàn)ERα-NTD具有特定的生物物理特性,包括兩個具有限制性主鏈流動性的區(qū)域(簇I和簇II),這些區(qū)域?qū)?yīng)于殘基結(jié)構(gòu),解釋了SEC-SAXS數(shù)據(jù)中觀察到的緊湊構(gòu)象。
疏水芳香簇
通過PRE測量發(fā)現(xiàn),簇I和簇II之間的相互作用表明殘基結(jié)構(gòu)起源于芳香氨基酸簇之間的特定疏水相互作用,這些相互作用橋接了這些富含芳香族的區(qū)域。
pSer118驅(qū)動簇分離
研究發(fā)現(xiàn),pSer118通過增加簇I和簇II之間的分離來觸發(fā)ERα-NTD的構(gòu)象變化,同時保持局部簇的完整性。這一發(fā)現(xiàn)表明,磷酸化通過增加簇分離來促進(jìn)ERα-NTD的擴(kuò)張。
疏水破壞簇相互作用
疏水破壞作為主要機(jī)制,包括非離子洗滌劑DDM的使用、Ser118附近的丙氨酸替代以及簇I中的丙氨酸突變,實(shí)驗(yàn)表明疏水相互作用的破壞是結(jié)構(gòu)變化的主要驅(qū)動力。
疏水恢復(fù)ER功能
研究人員比較了磷酸化缺陷(S118A)和磷酸模擬(S118D)突變,發(fā)現(xiàn)S118D表現(xiàn)出比S118A更強(qiáng)的轉(zhuǎn)錄活性。此外,S118A/F120A和S118A/L121A雙突變恢復(fù)了S118A受損的轉(zhuǎn)錄功能,表明疏水相互作用的破壞可以模擬磷酸化效應(yīng),恢復(fù)功能缺陷。
疏水突變調(diào)節(jié)輔因子相互作用和細(xì)胞生長
pSer118和F120A顯著減少了ERα-NTD與TIF2-QRD的相互作用。在TFF1啟動子上,S118A增強(qiáng)了TIF2的募集,而S118D和疏水突變逆轉(zhuǎn)了這一效應(yīng),同時保持了與WT類似的啟動子結(jié)合。這些結(jié)果表明,ERα-NTD的疏水簇調(diào)節(jié)輔因子相互作用和轉(zhuǎn)錄活性。
細(xì)胞生長的表型恢復(fù)
最后,研究人員進(jìn)一步探討了F120A和L121A突變對MCF7細(xì)胞生長和集落形成的影響。S118A未能促進(jìn)生長,而S118D的生長促進(jìn)能力與WT ER相當(dāng)或更高。F120A或L121A與S118A的組合恢復(fù)了與WT和S118D相當(dāng)?shù)纳L促進(jìn)能力。此外,Y52A/Y54A和Y60A/F62A突變也恢復(fù)了S118A受損的細(xì)胞生長和集落形成,支持了疏水破壞效應(yīng)在兩個簇中的作用。

圖2 ER-NTD中的疏水性聚集
研究結(jié)論與討論
本研究揭示了Ser118磷酸化如何通過影響ERα-NTD的疏水簇來調(diào)節(jié)其構(gòu)象和功能。這一發(fā)現(xiàn)不僅擴(kuò)展了我們對磷酸化在轉(zhuǎn)錄因子功能中作用的理解,還為開發(fā)針對ERα-NTD的直接靶向治療提供了新的策略。研究結(jié)果強(qiáng)調(diào)了疏水相互作用在磷酸化誘導(dǎo)的ERα-NTD變化中的主要作用,并為未來的藥物研發(fā)提供了新的靶點(diǎn)。通過破壞疏水相互作用,可以模擬磷酸化效應(yīng),恢復(fù)因磷酸化缺陷導(dǎo)致的功能障礙,這為乳腺癌的治療提供了新的思路和方法。
“就像機(jī)器需要特定的控制來運(yùn)作一樣,像雌激素受體這樣的蛋白質(zhì)控制著細(xì)胞的生長和行為,”凱斯綜合癌癥中心成員、醫(yī)學(xué)院營養(yǎng)學(xué)副教授Sichun Yang說。“我們在雌激素受體中發(fā)現(xiàn)了以前未知的‘分子開關(guān)’,這些開關(guān)雖然靈活,但卻以驚人的精度協(xié)同工作,協(xié)調(diào)細(xì)胞過程。改變蛋白質(zhì)的一部分可以引發(fā)連鎖反應(yīng),影響乳腺癌細(xì)胞的生長。”
雖然可能需要更多的研究來利用他們的發(fā)現(xiàn)來開發(fā)新的治療方法,但這一發(fā)現(xiàn)為科學(xué)家提供了遠(yuǎn)遠(yuǎn)超出乳腺癌的新工具和想法,因?yàn)轭愃频牡鞍踪|(zhì)區(qū)域涉及許多其他疾病。
“不是簡單地關(guān)閉雌激素受體,”Sichun Yang說,“未來的藥物可能會針對這些新發(fā)現(xiàn)的開關(guān)而設(shè)計(jì),為控制蛋白質(zhì)的工作方式提供新的方法。”
研究小組使用來自阿貢國家實(shí)驗(yàn)室先進(jìn)光子源和國家同步加速器光源II的小角度x射線散射和核磁共振波譜工具對蛋白質(zhì)開關(guān)進(jìn)行了非常詳細(xì)的研究。這項(xiàng)合作包括來自亞利桑那州立大學(xué)和俄亥俄州立大學(xué)的研究人員。美國國立衛(wèi)生研究院(National Institutes of Health)、美國癌癥協(xié)會(American Cancer Society)和玫琳凱愛施基金會(Mary Kay Ash Foundation)也提供了額外的支持。
“Yang的工作強(qiáng)調(diào)了利用尖端技術(shù)和團(tuán)隊(duì)合作來回答重大科學(xué)問題的重要性,”醫(yī)學(xué)院蛋白質(zhì)組學(xué)和生物信息學(xué)中心主任Mark Chance說。“這些國家設(shè)施使我們能夠取得突破,推動新的癌癥治療方法。”
參考資料
[1] The sequence–structure–function relationship of intrinsic ERα disorder



