摘要:研究人員近日發(fā)現(xiàn),一些侵襲性特別強(qiáng)的肺癌細(xì)胞可以形成自己的電網(wǎng)絡(luò)。
神經(jīng)元受體的異位表達(dá)會促進(jìn)許多癌癥類型的腫瘤進(jìn)展,而腺癌的神經(jīng)內(nèi)分泌轉(zhuǎn)化也與侵襲性增加有關(guān)。電興奮性這一神經(jīng)元的標(biāo)志性特征是否存在于癌細(xì)胞中,并對癌癥進(jìn)展產(chǎn)生影響,目前仍知之甚少。
弗朗西斯·克里克研究所(Francis Crick Institute)的研究人員近日發(fā)現(xiàn),一些侵襲性特別強(qiáng)的肺癌細(xì)胞可以形成自己的電網(wǎng)絡(luò),就像在人體神經(jīng)系統(tǒng)中觀察到的那樣。這種獨(dú)特的特性可以使它們減少對腫瘤周圍環(huán)境的依賴,甚至更容易擴(kuò)散。
 圖1 內(nèi)源性電活動(dòng)驅(qū)動(dòng)小細(xì)胞肺癌進(jìn)展
圖1 內(nèi)源性電活動(dòng)驅(qū)動(dòng)小細(xì)胞肺癌進(jìn)展這篇題為“Intrinsic electrical activity drives small-cell lung cancer progression”的論文于2025年2月12日發(fā)表在《Nature》雜志上。
小細(xì)胞肺癌(SCLC)是侵襲性最強(qiáng)的癌癥之一,三分之二的患者在初診時(shí)已出現(xiàn)遠(yuǎn)端轉(zhuǎn)移。這種癌癥主要源于神經(jīng)內(nèi)分泌(NE)細(xì)胞,它們幫助調(diào)節(jié)肺部的空氣和血液流動(dòng)。
在這項(xiàng)研究中,研究人員在人類和小鼠的小細(xì)胞肺癌樣本中尋找電活動(dòng),目的是確定這種活動(dòng)是否能支持這種癌癥類型的侵襲性。
利用神經(jīng)科學(xué)技術(shù),他們發(fā)現(xiàn)小細(xì)胞肺癌的細(xì)胞能夠產(chǎn)生自己的電活動(dòng),在腫瘤內(nèi)構(gòu)建自己的電網(wǎng)絡(luò),并逐漸獨(dú)立于人體的主要電力供應(yīng),包括腫瘤周圍的神經(jīng)。
由于發(fā)射電信號需要大量的能量,研究人員深入探究了這些能量是如何產(chǎn)生的。
研究團(tuán)隊(duì)注意到,隨著癌癥的進(jìn)展,基因表達(dá)發(fā)生了重要變化,導(dǎo)致一些細(xì)胞失去了它們的NE身份,變成了非神經(jīng)內(nèi)分泌(非NE)細(xì)胞。
他們還觀察到,這些癌細(xì)胞共同促進(jìn)了腫瘤的發(fā)展。在NE細(xì)胞中,負(fù)責(zé)電子通信的基因開啟,而在非NE細(xì)胞中,與產(chǎn)生支持性環(huán)境有關(guān)的基因開啟。
NE細(xì)胞和非NE細(xì)胞表現(xiàn)出的關(guān)系與神經(jīng)元和星形膠質(zhì)細(xì)胞相似。NE細(xì)胞產(chǎn)生電信號,而非NE細(xì)胞負(fù)責(zé)輸送乳酸,提供代謝上的支持。阻斷乳酸泵則降低了NE細(xì)胞的電活動(dòng),表明這種關(guān)系對腫瘤提供自身支持非常重要。
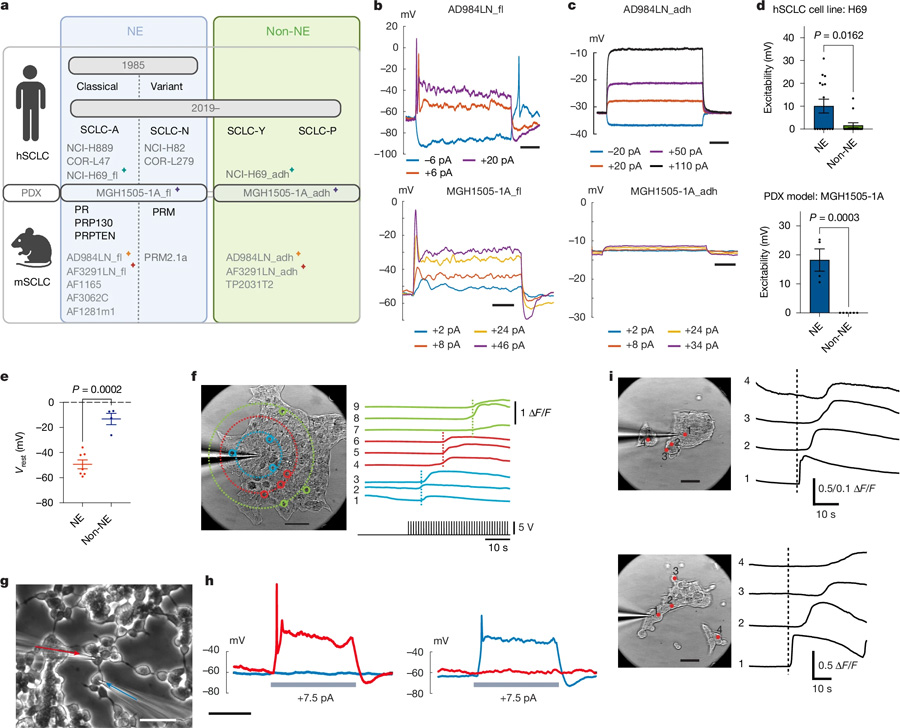
圖2 電激活的NE細(xì)胞產(chǎn)生自發(fā)和誘發(fā)的鈣波
研究人員還發(fā)現(xiàn),盡管非NE細(xì)胞攜帶相同的驅(qū)動(dòng)突變,但它們并沒有在小鼠體內(nèi)擴(kuò)散并引發(fā)腫瘤。因此,他們使用河豚毒素(TTX)來抑制電活動(dòng)。他們觀察到,TTX不能殺死培養(yǎng)皿中的NE細(xì)胞,但會降低它們形成腫瘤的潛力,而對非NE細(xì)胞沒有影響。
最后,研究人員分析了一組指示肺癌患者電活動(dòng)增加的分子標(biāo)志物,發(fā)現(xiàn)與鄰近的健康細(xì)胞相比,這些標(biāo)志物在癌細(xì)胞中升高。他們還觀察到,隨著癌癥的進(jìn)展,非NE細(xì)胞顯示出的標(biāo)志物表明,它們越來越多地泵出乳酸。NE細(xì)胞供能模式的這些變化與大多數(shù)癌癥類型不同。
總的來說,這些結(jié)果表明,NE細(xì)胞的電活動(dòng)推動(dòng)了腫瘤生長和擴(kuò)散的能力,這正是癌癥患者死亡的主要原因。
通訊作者、癌癥-神經(jīng)科學(xué)實(shí)驗(yàn)室的負(fù)責(zé)人Leanne Li表示:“我們知道一些癌細(xì)胞可以模仿神經(jīng)行為,但我們不知道形成一個(gè)獨(dú)立的電網(wǎng)絡(luò)會如何影響疾病的發(fā)展。通過結(jié)合神經(jīng)科學(xué)和癌癥研究技術(shù),我們能夠從不同的角度來認(rèn)識這種疾病。”
“若要了解這種電活動(dòng)的生物學(xué)影響,以及使腫瘤變得更具侵襲性和更難治療的具體疾病機(jī)制,還有很長一段路要走。不過,我們希望通過了解為癌細(xì)胞提供能量的方式,暴露出癌癥弱點(diǎn),以便未來實(shí)現(xiàn)靶向治療。”
下一步,研究人員計(jì)劃研究電活動(dòng)對其他癌癥類型的影響,并探索以這一特性為靶點(diǎn)是否可以帶來新的治療方案。
參考資料
[1] Intrinsic electrical activity drives small-cell lung cancer progression
摘要:研究人員近日發(fā)現(xiàn),一些侵襲性特別強(qiáng)的肺癌細(xì)胞可以形成自己的電網(wǎng)絡(luò)。
神經(jīng)元受體的異位表達(dá)會促進(jìn)許多癌癥類型的腫瘤進(jìn)展,而腺癌的神經(jīng)內(nèi)分泌轉(zhuǎn)化也與侵襲性增加有關(guān)。電興奮性這一神經(jīng)元的標(biāo)志性特征是否存在于癌細(xì)胞中,并對癌癥進(jìn)展產(chǎn)生影響,目前仍知之甚少。
弗朗西斯·克里克研究所(Francis Crick Institute)的研究人員近日發(fā)現(xiàn),一些侵襲性特別強(qiáng)的肺癌細(xì)胞可以形成自己的電網(wǎng)絡(luò),就像在人體神經(jīng)系統(tǒng)中觀察到的那樣。這種獨(dú)特的特性可以使它們減少對腫瘤周圍環(huán)境的依賴,甚至更容易擴(kuò)散。
 圖1 內(nèi)源性電活動(dòng)驅(qū)動(dòng)小細(xì)胞肺癌進(jìn)展
圖1 內(nèi)源性電活動(dòng)驅(qū)動(dòng)小細(xì)胞肺癌進(jìn)展這篇題為“Intrinsic electrical activity drives small-cell lung cancer progression”的論文于2025年2月12日發(fā)表在《Nature》雜志上。
小細(xì)胞肺癌(SCLC)是侵襲性最強(qiáng)的癌癥之一,三分之二的患者在初診時(shí)已出現(xiàn)遠(yuǎn)端轉(zhuǎn)移。這種癌癥主要源于神經(jīng)內(nèi)分泌(NE)細(xì)胞,它們幫助調(diào)節(jié)肺部的空氣和血液流動(dòng)。
在這項(xiàng)研究中,研究人員在人類和小鼠的小細(xì)胞肺癌樣本中尋找電活動(dòng),目的是確定這種活動(dòng)是否能支持這種癌癥類型的侵襲性。
利用神經(jīng)科學(xué)技術(shù),他們發(fā)現(xiàn)小細(xì)胞肺癌的細(xì)胞能夠產(chǎn)生自己的電活動(dòng),在腫瘤內(nèi)構(gòu)建自己的電網(wǎng)絡(luò),并逐漸獨(dú)立于人體的主要電力供應(yīng),包括腫瘤周圍的神經(jīng)。
由于發(fā)射電信號需要大量的能量,研究人員深入探究了這些能量是如何產(chǎn)生的。
研究團(tuán)隊(duì)注意到,隨著癌癥的進(jìn)展,基因表達(dá)發(fā)生了重要變化,導(dǎo)致一些細(xì)胞失去了它們的NE身份,變成了非神經(jīng)內(nèi)分泌(非NE)細(xì)胞。
他們還觀察到,這些癌細(xì)胞共同促進(jìn)了腫瘤的發(fā)展。在NE細(xì)胞中,負(fù)責(zé)電子通信的基因開啟,而在非NE細(xì)胞中,與產(chǎn)生支持性環(huán)境有關(guān)的基因開啟。
NE細(xì)胞和非NE細(xì)胞表現(xiàn)出的關(guān)系與神經(jīng)元和星形膠質(zhì)細(xì)胞相似。NE細(xì)胞產(chǎn)生電信號,而非NE細(xì)胞負(fù)責(zé)輸送乳酸,提供代謝上的支持。阻斷乳酸泵則降低了NE細(xì)胞的電活動(dòng),表明這種關(guān)系對腫瘤提供自身支持非常重要。

圖2 電激活的NE細(xì)胞產(chǎn)生自發(fā)和誘發(fā)的鈣波
研究人員還發(fā)現(xiàn),盡管非NE細(xì)胞攜帶相同的驅(qū)動(dòng)突變,但它們并沒有在小鼠體內(nèi)擴(kuò)散并引發(fā)腫瘤。因此,他們使用河豚毒素(TTX)來抑制電活動(dòng)。他們觀察到,TTX不能殺死培養(yǎng)皿中的NE細(xì)胞,但會降低它們形成腫瘤的潛力,而對非NE細(xì)胞沒有影響。
最后,研究人員分析了一組指示肺癌患者電活動(dòng)增加的分子標(biāo)志物,發(fā)現(xiàn)與鄰近的健康細(xì)胞相比,這些標(biāo)志物在癌細(xì)胞中升高。他們還觀察到,隨著癌癥的進(jìn)展,非NE細(xì)胞顯示出的標(biāo)志物表明,它們越來越多地泵出乳酸。NE細(xì)胞供能模式的這些變化與大多數(shù)癌癥類型不同。
總的來說,這些結(jié)果表明,NE細(xì)胞的電活動(dòng)推動(dòng)了腫瘤生長和擴(kuò)散的能力,這正是癌癥患者死亡的主要原因。
通訊作者、癌癥-神經(jīng)科學(xué)實(shí)驗(yàn)室的負(fù)責(zé)人Leanne Li表示:“我們知道一些癌細(xì)胞可以模仿神經(jīng)行為,但我們不知道形成一個(gè)獨(dú)立的電網(wǎng)絡(luò)會如何影響疾病的發(fā)展。通過結(jié)合神經(jīng)科學(xué)和癌癥研究技術(shù),我們能夠從不同的角度來認(rèn)識這種疾病。”
“若要了解這種電活動(dòng)的生物學(xué)影響,以及使腫瘤變得更具侵襲性和更難治療的具體疾病機(jī)制,還有很長一段路要走。不過,我們希望通過了解為癌細(xì)胞提供能量的方式,暴露出癌癥弱點(diǎn),以便未來實(shí)現(xiàn)靶向治療。”
下一步,研究人員計(jì)劃研究電活動(dòng)對其他癌癥類型的影響,并探索以這一特性為靶點(diǎn)是否可以帶來新的治療方案。
參考資料
[1] Intrinsic electrical activity drives small-cell lung cancer progression



