結腸癌是一種發生于人體結腸部位的消化道惡性腫瘤,多發于40-50歲。隨著社會的發展,人們的生活習慣逐漸受多種外來文化的影響發生了巨大的變化,偏好重口味、高糖高脂飲食、饑飽失常、飲食不潔、熬夜,使結腸癌的發病日趨于年輕化。
近日, 學術期刊《Nature》三連發表重磅文章拆穿了癌細胞的“把戲”,為結腸癌高危人群提供了新的預防策略。同時,《Nature》還在線發表題為Cancer stem cells in the gut have a bad influence on neighbouringcells的 News & Views,提供了有關癌細胞及其鄰近細胞在腸道中的競爭動態的重要見解。

眾所周知,干細胞是一類具有無限的或者永生的自我更新能力的細胞、能夠產生至少一種類型的、高度分化的子代細胞,如果不把體內的癌癥干細胞徹底清除,發生突變的腸道干細胞就會“策反”周圍健康細胞,抑制周圍健康的腸道干細胞活性,使癌癥復發和轉移。
而干細胞中的腺瘤性結腸息肉(APC)病基因作為結直腸癌抑癌基因,是胚系和體突變較常發生部位。當該基因發生突變時,會誘導b-catenin的磷酸化和降解,負調控WNT途徑,誘發結腸癌。為此,科學家們一直致力于將癌癥干細胞斬草除根。
近年來,隨著深度靶向 DNA 測序等技術的推進,研究人員注意到人體正常組織中早已潛伏了與癌癥相關的突變基因。因此,為了探明促癌突變細胞與正常的鄰近細胞之間的相互作用,劍橋干細胞研究所的科研人員開發了一種顯微技術,使用多色標記技術來追蹤單個突變基因Kras和Pik3ca的軌跡,研究發現,突變的癌癥干細胞竟能分泌特定的細胞因子,抑制周圍健康的腸道干細胞活性。

當然,研究人員的科研進程并未止步于此。英國癌癥研究中心的科研人員建立了一個體外細胞培養系統,使單個細胞在體外環境發育成“小腸類器官”結構,以評估干細胞的活力。
令人振奮的是,試驗發現了引起Apc突變的關鍵媒介"NOTUM基因",與正常細胞相比,該基因在Apc突變細胞譜系中表現出更高的表達量,可作為預防Apc突變型結直腸癌的靶點,并可通過遺傳或藥物方式抑制NOTUM,從而抑制Apc突變細胞的擴張和腸道腺瘤的形成。

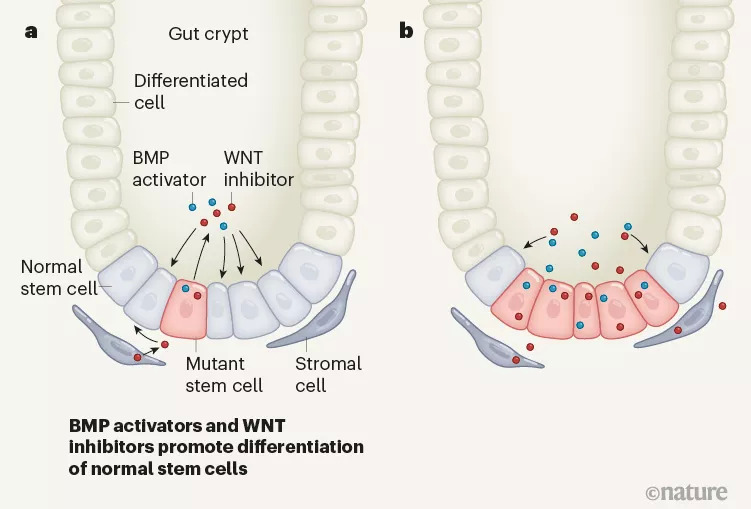
為了深入研究正常和惡性干細胞之間相互作用的機制,荷蘭阿姆斯特丹大學醫學中心的研究者們通過構建Apc基因失活介導的小鼠和人類腸癌模型,發現APC介導的b-catenin是一種有助于維持腸道干細胞狀態的基因表達調節劑,會積極抑制鄰近細胞的生長甚至誘導野生型腸道干細胞凋亡。
不僅如此,攜帶Apc突變的癌癥干細胞相比于正常干細胞時有更強的競爭優勢,這種優勢是由于Apc突變細胞能分泌WNT拮抗因子,不僅抑制了正常干細胞的活性,還會促進其分化。而研究發現,氯化鋰能消除WNT拮抗因子的抑制作用,為預防腸癌提供了新的策略。

迄今為止,醫學界在癌癥領域的研究重點一直放在促進免疫系統介導的防御上。然而,如今干細胞和組織環境對腫瘤的重要性也慢慢被挖掘,在未來的進一步研究中,如果能夠在Apc基因突變的小鼠模型中使WNT信號通路重啟、并限制NOTUM的功能,就有望抑制腫瘤的發生與發展。
總而言之,這三項突破性研究給今后的癌癥治療提供了新的思路,可以通過抑制惡性腫瘤干細胞的分化作用來消除癌癥的競爭優勢,未來,期待科學家能針對這一特性開發全新的抗癌療法。



