摘要:最近,德國(guó)弗萊堡大學(xué)醫(yī)學(xué)院的一個(gè)研究團(tuán)隊(duì)開(kāi)發(fā)出一種活性物質(zhì),未來(lái)有望成為新的治療選擇。
在德國(guó),每年有65,000多名男性罹患前列腺癌。其中,大約12,000人發(fā)展為耐藥性癌癥,最終導(dǎo)致死亡。前列腺癌一般發(fā)展緩慢,直到疾病晚期才出現(xiàn)癥狀。
最近,德國(guó)弗萊堡大學(xué)醫(yī)學(xué)院的一個(gè)研究團(tuán)隊(duì)開(kāi)發(fā)出一種活性物質(zhì),未來(lái)有望成為新的治療選擇。這種被稱為KMI169的化合物靶向一種在前列腺癌發(fā)展過(guò)程中起重要作用的酶。
這項(xiàng)研究成果于2024年1月2日發(fā)表在《Nature Communications》雜志上,對(duì)于在常規(guī)治療中出現(xiàn)耐藥性的其他癌癥也同樣表現(xiàn)出巨大的潛力。
 圖1 具有細(xì)胞活性的甲基轉(zhuǎn)移酶選擇性抑制劑KMT9的結(jié)構(gòu)導(dǎo)向設(shè)計(jì)
圖1 具有細(xì)胞活性的甲基轉(zhuǎn)移酶選擇性抑制劑KMT9的結(jié)構(gòu)導(dǎo)向設(shè)計(jì)通過(guò)小分子來(lái)抑制表觀遺傳調(diào)控因子是一種極具吸引力的癌癥治療策略。研究人員之前分析了賴氨酸甲基轉(zhuǎn)移酶9(KMT9)在前列腺癌、肺癌和結(jié)腸癌中的作用。他們觀察到,腫瘤細(xì)胞的增殖需要這種酶的活性,因此KMT9是一種潛在的治療靶點(diǎn)。
于是,他們通過(guò)基于結(jié)構(gòu)的藥物設(shè)計(jì)開(kāi)發(fā)出一種強(qiáng)效的選擇性抑制劑KMI169。KMI169是一種雙底物抑制劑,以輔因子S-腺苷-L-甲硫氨酸(SAM)和KMT9的底物結(jié)合口袋為靶點(diǎn),具有高效力和高選擇性。
抑制KMT9可以選擇性地下調(diào)參與細(xì)胞周期調(diào)控的目標(biāo)基因,并抑制腫瘤細(xì)胞的增殖,包括對(duì)去勢(shì)和恩雜魯胺(enzalutamide)產(chǎn)生耐藥性的前列腺癌細(xì)胞。
通訊作者、弗萊堡大學(xué)的Roland Schüle教授和Eric Metzger博士稱:“長(zhǎng)期以來(lái),我們一直關(guān)注KMT9酶,將其作為前列腺癌的潛在靶點(diǎn)。如今這種特異性抑制劑的開(kāi)發(fā)是朝著更有效地抗擊前列腺癌邁出了決定性的一步。”
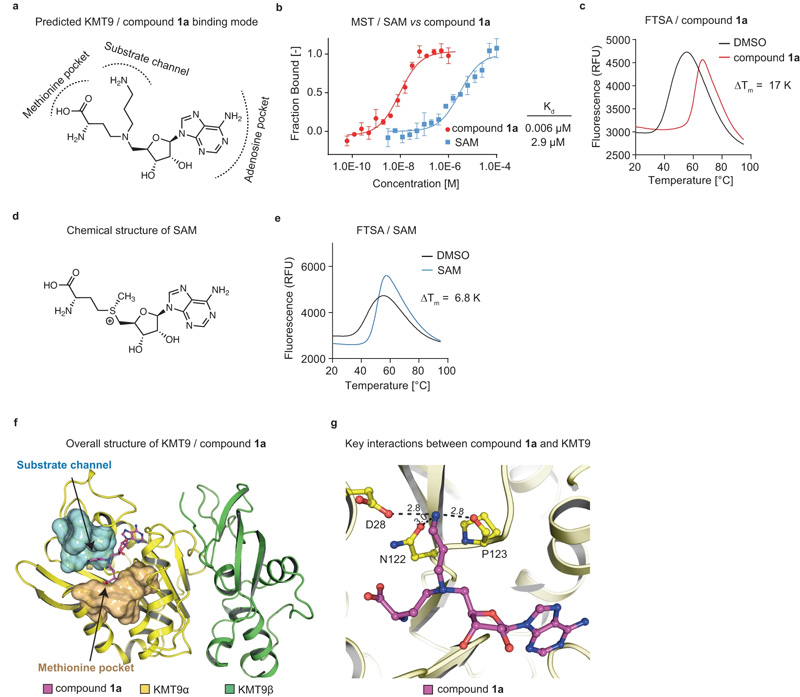
圖2 KMT9雙底物抑制劑的鑒定
這種化合物可用于耐藥性癌癥的治療,因此特別有價(jià)值。“治療耐藥性意味著經(jīng)典的抗激素療法往往在幾個(gè)月內(nèi)就會(huì)失效,然后疾病迅速發(fā)展。我們開(kāi)發(fā)的抑制劑提供了一種高度創(chuàng)新的治療方法,” Schüle教授說(shuō)。
他們的合作者、弗萊堡大學(xué)的Manfred Jung教授表示:“這種抑制劑就像鎖和鑰匙一樣緊密配合,阻斷了KMT9的功能,因此也阻斷了前列腺癌和膀胱癌細(xì)胞的生長(zhǎng)。在晶體結(jié)構(gòu)分析的指導(dǎo)下,我們對(duì)這種化合物進(jìn)行了多次改良,以提高其效力、選擇性和藥用性能。”
KMI169抑制劑不僅是探究KMT9功能的重要工具,也為開(kāi)發(fā)臨床候選抑制劑來(lái)治療惡性腫瘤鋪平了道路。
參考資料
[1] Structure-guided design of a selective inhibitor of the methyltransferase KMT9 with cellular activity
摘要:最近,德國(guó)弗萊堡大學(xué)醫(yī)學(xué)院的一個(gè)研究團(tuán)隊(duì)開(kāi)發(fā)出一種活性物質(zhì),未來(lái)有望成為新的治療選擇。
在德國(guó),每年有65,000多名男性罹患前列腺癌。其中,大約12,000人發(fā)展為耐藥性癌癥,最終導(dǎo)致死亡。前列腺癌一般發(fā)展緩慢,直到疾病晚期才出現(xiàn)癥狀。
最近,德國(guó)弗萊堡大學(xué)醫(yī)學(xué)院的一個(gè)研究團(tuán)隊(duì)開(kāi)發(fā)出一種活性物質(zhì),未來(lái)有望成為新的治療選擇。這種被稱為KMI169的化合物靶向一種在前列腺癌發(fā)展過(guò)程中起重要作用的酶。
這項(xiàng)研究成果于2024年1月2日發(fā)表在《Nature Communications》雜志上,對(duì)于在常規(guī)治療中出現(xiàn)耐藥性的其他癌癥也同樣表現(xiàn)出巨大的潛力。
 圖1 具有細(xì)胞活性的甲基轉(zhuǎn)移酶選擇性抑制劑KMT9的結(jié)構(gòu)導(dǎo)向設(shè)計(jì)
圖1 具有細(xì)胞活性的甲基轉(zhuǎn)移酶選擇性抑制劑KMT9的結(jié)構(gòu)導(dǎo)向設(shè)計(jì)通過(guò)小分子來(lái)抑制表觀遺傳調(diào)控因子是一種極具吸引力的癌癥治療策略。研究人員之前分析了賴氨酸甲基轉(zhuǎn)移酶9(KMT9)在前列腺癌、肺癌和結(jié)腸癌中的作用。他們觀察到,腫瘤細(xì)胞的增殖需要這種酶的活性,因此KMT9是一種潛在的治療靶點(diǎn)。
于是,他們通過(guò)基于結(jié)構(gòu)的藥物設(shè)計(jì)開(kāi)發(fā)出一種強(qiáng)效的選擇性抑制劑KMI169。KMI169是一種雙底物抑制劑,以輔因子S-腺苷-L-甲硫氨酸(SAM)和KMT9的底物結(jié)合口袋為靶點(diǎn),具有高效力和高選擇性。
抑制KMT9可以選擇性地下調(diào)參與細(xì)胞周期調(diào)控的目標(biāo)基因,并抑制腫瘤細(xì)胞的增殖,包括對(duì)去勢(shì)和恩雜魯胺(enzalutamide)產(chǎn)生耐藥性的前列腺癌細(xì)胞。
通訊作者、弗萊堡大學(xué)的Roland Schüle教授和Eric Metzger博士稱:“長(zhǎng)期以來(lái),我們一直關(guān)注KMT9酶,將其作為前列腺癌的潛在靶點(diǎn)。如今這種特異性抑制劑的開(kāi)發(fā)是朝著更有效地抗擊前列腺癌邁出了決定性的一步。”

圖2 KMT9雙底物抑制劑的鑒定
這種化合物可用于耐藥性癌癥的治療,因此特別有價(jià)值。“治療耐藥性意味著經(jīng)典的抗激素療法往往在幾個(gè)月內(nèi)就會(huì)失效,然后疾病迅速發(fā)展。我們開(kāi)發(fā)的抑制劑提供了一種高度創(chuàng)新的治療方法,” Schüle教授說(shuō)。
他們的合作者、弗萊堡大學(xué)的Manfred Jung教授表示:“這種抑制劑就像鎖和鑰匙一樣緊密配合,阻斷了KMT9的功能,因此也阻斷了前列腺癌和膀胱癌細(xì)胞的生長(zhǎng)。在晶體結(jié)構(gòu)分析的指導(dǎo)下,我們對(duì)這種化合物進(jìn)行了多次改良,以提高其效力、選擇性和藥用性能。”
KMI169抑制劑不僅是探究KMT9功能的重要工具,也為開(kāi)發(fā)臨床候選抑制劑來(lái)治療惡性腫瘤鋪平了道路。
參考資料
[1] Structure-guided design of a selective inhibitor of the methyltransferase KMT9 with cellular activity



