摘要:EPFL科學家的一項新研究提供了一種很有前途的解決方案。
腫瘤細胞經常劫持正常的生理過程來支持它們的生長,利用負責基本細胞功能的蛋白質。因此,重要的是僅在癌細胞中阻斷這些蛋白質的活性,而不影響它們在健康組織中的關鍵作用。出于這個原因,使用小分子誘導全身抑制身體所有細胞的經典方法可能會導致嚴重的副作用。
被癌細胞劫持的基本蛋白質的一個例子是組織蛋白酶,這是一個酶家族,負責分解其他蛋白質并重塑身體組織。組織蛋白酶與多種癌癥、骨質疏松癥和自身免疫性疾病有關。然而,小分子組織蛋白酶抑制劑的臨床試驗由于缺乏療效或毒性而失敗。

圖1 抗體-肽偶聯物提供共價抑制劑阻斷致癌組織蛋白酶
現在,由EPFL的Elisa Oricchio和Bruno Correia領導的一組科學家已經開發出一種新的方法來克服這些限制。他們創建了一個模塊化藥物平臺,將非天然肽抑制劑(nnpi)與抗體偶聯,產生抗體-肽抑制劑偶聯物(APICs)。這種方法確保了抑制劑被特異性地遞送到癌細胞,從而減少了全身副作用,提高了治療效果。
研究人員首先設計了共價結合并抑制組織蛋白酶的NNPIs。他們修改了肽序列,使其包括一個邁克爾受體,這是一個化學片段,使其更容易與組織蛋白酶形成穩定的結合。
Michael受體與組織蛋白酶活性部位的半胱氨酸殘基(負責其主要工作的酶的部分)發生反應,產生穩定的共價連鎖,有效地抑制組織蛋白酶。為了進一步優化肽的特異性和效力,研究小組使用了飽和誘變篩選——一種系統地改變蛋白質中的每個氨基酸以找到具有所需特性的最佳變體的方法。
研究人員發現了幾種針對四種不同組織蛋白酶的強抑制劑,即組織蛋白酶S、B、K和l。通過將這些抑制劑附著在識別CD22、CD79、HER2和Siglec15的抗體上,研究人員可以精確地將nnpi傳遞給淋巴瘤細胞、乳腺癌細胞和破骨細胞。這利用了抗體被靶細胞內化的自然能力,精確地將抑制劑定向到需要它們的地方。
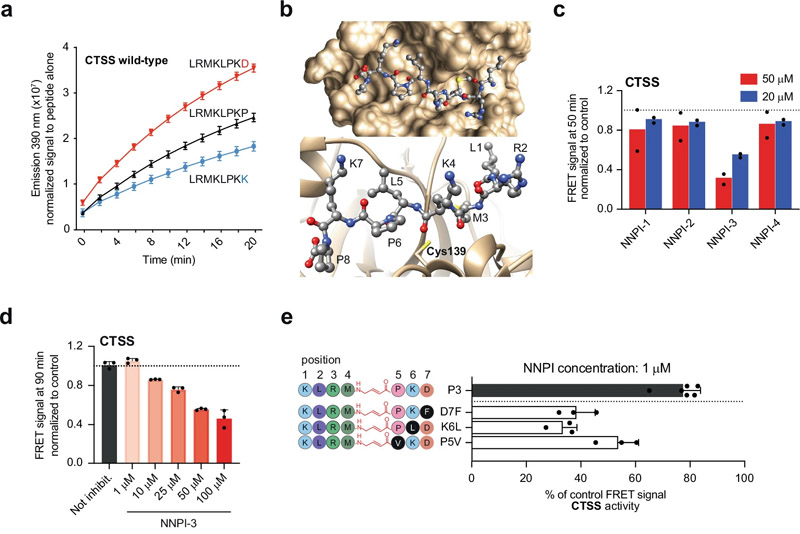
圖2 針對CTSS或CTSB的NNPI的設計和開發
然后,是時候測試APICs了:在細胞系和動物模型中,它們都顯示出顯著的治療效果。例如,在淋巴瘤模型中,使用靶向組織蛋白酶S的APICs治療可導致腫瘤縮小并激活針對癌細胞的免疫反應。在乳腺癌模型中,靶向組織蛋白酶B的APICs抑制腫瘤侵襲性和細胞遷移,強調APICs預防轉移的潛力。
通過將抑制劑特異性地遞送到癌細胞,APIC方法可以避免或最大限度地減少與其他治療(如化療)相關的副作用。此外,APIC設計的模塊化特性意味著它可以針對與不同疾病有關的各種蛋白酶,這可能會徹底改變癌癥以外疾病的治療前景。
APIC項目現在已經走出了實驗室,并邁出了臨床現實的第一步?!拔覀兏鶕@個項目提交了兩項專利申請,”Elisa Oricchio說。“Aaron Petruzzella是該項目的博士生,他最近得到了SNF Bridge概念驗證獎學金的支持,繼續研究這些抑制劑,為創業奠定基礎,吸引潛在投資者的注意?!?/div>
參考資料
[1] Antibody–peptide conjugates deliver covalent inhibitors blocking oncogenic cathepsins
摘要:EPFL科學家的一項新研究提供了一種很有前途的解決方案。
腫瘤細胞經常劫持正常的生理過程來支持它們的生長,利用負責基本細胞功能的蛋白質。因此,重要的是僅在癌細胞中阻斷這些蛋白質的活性,而不影響它們在健康組織中的關鍵作用。出于這個原因,使用小分子誘導全身抑制身體所有細胞的經典方法可能會導致嚴重的副作用。
被癌細胞劫持的基本蛋白質的一個例子是組織蛋白酶,這是一個酶家族,負責分解其他蛋白質并重塑身體組織。組織蛋白酶與多種癌癥、骨質疏松癥和自身免疫性疾病有關。然而,小分子組織蛋白酶抑制劑的臨床試驗由于缺乏療效或毒性而失敗。

圖1 抗體-肽偶聯物提供共價抑制劑阻斷致癌組織蛋白酶
現在,由EPFL的Elisa Oricchio和Bruno Correia領導的一組科學家已經開發出一種新的方法來克服這些限制。他們創建了一個模塊化藥物平臺,將非天然肽抑制劑(nnpi)與抗體偶聯,產生抗體-肽抑制劑偶聯物(APICs)。這種方法確保了抑制劑被特異性地遞送到癌細胞,從而減少了全身副作用,提高了治療效果。
研究人員首先設計了共價結合并抑制組織蛋白酶的NNPIs。他們修改了肽序列,使其包括一個邁克爾受體,這是一個化學片段,使其更容易與組織蛋白酶形成穩定的結合。
Michael受體與組織蛋白酶活性部位的半胱氨酸殘基(負責其主要工作的酶的部分)發生反應,產生穩定的共價連鎖,有效地抑制組織蛋白酶。為了進一步優化肽的特異性和效力,研究小組使用了飽和誘變篩選——一種系統地改變蛋白質中的每個氨基酸以找到具有所需特性的最佳變體的方法。
研究人員發現了幾種針對四種不同組織蛋白酶的強抑制劑,即組織蛋白酶S、B、K和l。通過將這些抑制劑附著在識別CD22、CD79、HER2和Siglec15的抗體上,研究人員可以精確地將nnpi傳遞給淋巴瘤細胞、乳腺癌細胞和破骨細胞。這利用了抗體被靶細胞內化的自然能力,精確地將抑制劑定向到需要它們的地方。

圖2 針對CTSS或CTSB的NNPI的設計和開發
然后,是時候測試APICs了:在細胞系和動物模型中,它們都顯示出顯著的治療效果。例如,在淋巴瘤模型中,使用靶向組織蛋白酶S的APICs治療可導致腫瘤縮小并激活針對癌細胞的免疫反應。在乳腺癌模型中,靶向組織蛋白酶B的APICs抑制腫瘤侵襲性和細胞遷移,強調APICs預防轉移的潛力。
通過將抑制劑特異性地遞送到癌細胞,APIC方法可以避免或最大限度地減少與其他治療(如化療)相關的副作用。此外,APIC設計的模塊化特性意味著它可以針對與不同疾病有關的各種蛋白酶,這可能會徹底改變癌癥以外疾病的治療前景。
APIC項目現在已經走出了實驗室,并邁出了臨床現實的第一步?!拔覀兏鶕@個項目提交了兩項專利申請,”Elisa Oricchio說?!癆aron Petruzzella是該項目的博士生,他最近得到了SNF Bridge概念驗證獎學金的支持,繼續研究這些抑制劑,為創業奠定基礎,吸引潛在投資者的注意。”
參考資料
[1] Antibody–peptide conjugates deliver covalent inhibitors blocking oncogenic cathepsins



