摘要:通過捕獲短壽命RNA分子,科學家們可以繪制出基因和控制它們的調(diào)控元件之間的關(guān)系。
人類基因組包含大約23000個基因,但在任何給定時間,這些基因中只有一小部分在細胞內(nèi)被激活。控制基因表達的調(diào)控元件的復(fù)雜網(wǎng)絡(luò)包括基因組中稱為增強子的區(qū)域,這些區(qū)域通常位于遠離它們所調(diào)節(jié)的基因的地方。
這種距離使得繪制基因和增強子之間復(fù)雜的相互作用圖譜變得困難。為了克服這個問題,麻省理工學院的研究人員發(fā)明了一種新技術(shù),使他們能夠觀察細胞中基因和增強子激活的時間。當一個基因與一個特定的增強子幾乎同時被激活時,它強烈表明該增強子控制著該基因。
在不同類型的細胞中,更多地了解哪些增強子控制哪些基因,可以幫助研究人員確定遺傳疾病的潛在藥物靶點。基因組研究已經(jīng)確定了許多與多種疾病有關(guān)的非蛋白質(zhì)編碼區(qū)域的突變。這些可能是未知的增強劑嗎?
“當人們開始使用基因技術(shù)來識別具有疾病信息的染色體區(qū)域時,大多數(shù)這些位點并不對應(yīng)于基因。我們懷疑它們對應(yīng)于這些增強子,這些增強子可能離啟動子很遠,所以能夠識別這些增強子是非常重要的,”麻省理工學院名譽教授、麻省理工學院科赫綜合癌癥研究所成員Phillip Sharp說。
Sharp是今天發(fā)表在《Nature》雜志上的這項新研究的資深作者。麻省理工學院研究助理D.B. Jay Mahat是該論文的主要作者。

圖1 單細胞新生RNA測序揭示協(xié)調(diào)的全球轉(zhuǎn)錄
尋找eRNA
不到2%的人類基因組是由蛋白質(zhì)編碼基因組成的。基因組的其余部分包括許多控制這些基因何時以及如何表達的元素。增強子被認為是在45年前發(fā)現(xiàn)的,它通過與基因啟動子區(qū)域的物理接觸,短暫地形成一個復(fù)合物,從而開啟基因。
最近,在2010年,研究人員發(fā)現(xiàn)這些增強子被轉(zhuǎn)錄成RNA分子,稱為增強子RNA或eRNA。科學家們懷疑,當增強子與靶基因積極相互作用時,這種轉(zhuǎn)錄就會發(fā)生。這就提出了一種可能性,即測量eRNA轉(zhuǎn)錄水平可以幫助研究人員確定增強子何時活躍,以及它針對哪些基因。
Mahat說:“這些信息對于理解細胞如何發(fā)育、理解癌癥如何改變它們的調(diào)控程序、激活導(dǎo)致去分化和轉(zhuǎn)移性生長的過程非常重要。”
然而,由于eRNA產(chǎn)生的數(shù)量非常少,并且在細胞中不能持續(xù)很長時間,因此這種繪制已被證明是困難的。此外,eRNA缺乏一種被稱為poly-A尾巴的修飾,這是大多數(shù)技術(shù)用來將RNA從細胞中拉出的“鉤子”。
捕獲eRNA的一種方法是向細胞中添加一個核苷酸,該核苷酸在與RNA結(jié)合時停止轉(zhuǎn)錄。這些核苷酸還含有一種叫做生物素的標簽,可以用來將RNA從細胞中撈出來。然而,目前的技術(shù)只適用于大量細胞,并不能提供單個細胞的信息。
在集思集想捕獲eRNA的新方法時,Mahat和Sharp考慮使用點擊化學,一種可以將兩個分子連接在一起的技術(shù),如果它們每個都被標記上可以一起反應(yīng)的“點擊手柄”。
研究人員設(shè)計了一鍵式手柄標記的核苷酸,一旦這些核苷酸被整合到生長的eRNA鏈中,這些鏈就可以用包含互補手柄的標簽打撈出來。這使得研究人員能夠捕獲eRNA,然后對其進行純化、擴增和測序。每一步都會丟失一些RNA,但Mahat估計他們可以成功地從一個給定的細胞中提取出大約10%的eRNA。
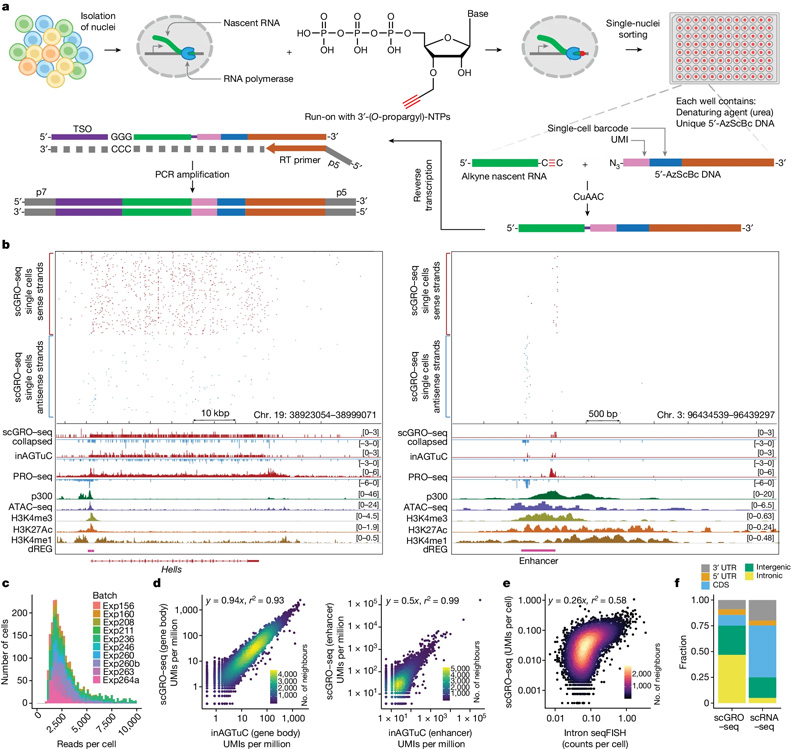
圖2 單細胞新生RNA測序的示意圖和基準
利用這項技術(shù),研究人員獲得了細胞中在給定時間內(nèi)活躍轉(zhuǎn)錄的增強子和基因的快照。
“你希望能夠確定,在每個細胞中,從調(diào)控元件和相應(yīng)基因的轉(zhuǎn)錄激活。這必須在單個細胞中完成,因為這是你可以檢測調(diào)節(jié)元件和基因之間的同步或異步的地方,”Mahat說。
基因表達的時機
研究人員在小鼠胚胎干細胞中展示了他們的技術(shù),他們發(fā)現(xiàn)他們可以根據(jù)RNA鏈的長度和聚合酶(負責轉(zhuǎn)錄的酶)的速度——也就是說,聚合酶每秒轉(zhuǎn)錄的距離——計算出特定區(qū)域開始轉(zhuǎn)錄的大致時間。這使他們能夠確定哪些基因和增強子在大約同一時間被轉(zhuǎn)錄。
研究人員使用這種方法比以前更詳細地確定細胞周期基因表達的時間。他們還能夠確認幾組已知的基因增強子對,并生成了一個大約5萬個可能的增強子基因?qū)Φ牧斜恚麄儸F(xiàn)在可以嘗試驗證這些基因?qū)Α?/div>
了解哪些增強子控制哪些基因,對于開發(fā)針對遺傳基礎(chǔ)疾病的新療法將證明是有價值的。去年,美國食品和藥物管理局(Food and Drug Administration)批準了首個治療鐮狀細胞性貧血的基因療法,該療法通過干擾一種增強劑來激活胎兒珠蛋白基因,從而減少鐮狀血細胞的產(chǎn)生。
麻省理工學院的研究小組現(xiàn)在正將這種方法應(yīng)用于其他類型的細胞,重點是自身免疫性疾病。他們正在與波士頓兒童醫(yī)院的研究人員合作,探索與狼瘡有關(guān)的免疫細胞突變,其中許多是在基因組的非編碼區(qū)域發(fā)現(xiàn)的。
“目前還不清楚哪些基因受到這些突變的影響,所以我們開始梳理這些假定的增強子可能調(diào)節(jié)的基因,以及這些增強子在哪些細胞類型中是活躍的,”Mahat說。“這是一個創(chuàng)建基因到增強子圖譜的工具,這是理解生物學的基礎(chǔ),也是理解疾病的基礎(chǔ)。”
這項研究的發(fā)現(xiàn)也為Sharp最近與麻省理工學院教授理查德·楊和Arup Chakraborty共同提出的一個理論提供了證據(jù),該理論認為基因轉(zhuǎn)錄是由被稱為冷凝物的無膜液滴控制的。這些凝聚物是由大量的酶和RNA組成的,Sharp認為其中可能包括在增強子位點產(chǎn)生的eRNA。
“我們認為增強子和啟動子之間的交流是一種凝聚型的瞬態(tài)結(jié)構(gòu),RNA是其中的一部分。這是一項重要的工作,有助于理解來自增強子的RNA是如何被激活的。
這項研究由美國國家癌癥研究所、美國國立衛(wèi)生研究院和祖母綠基金會博士后過渡獎資助。
參考資料
[1] Single-cell nascent RNA sequencing unveils coordinated global transcription
摘要:通過捕獲短壽命RNA分子,科學家們可以繪制出基因和控制它們的調(diào)控元件之間的關(guān)系。
人類基因組包含大約23000個基因,但在任何給定時間,這些基因中只有一小部分在細胞內(nèi)被激活。控制基因表達的調(diào)控元件的復(fù)雜網(wǎng)絡(luò)包括基因組中稱為增強子的區(qū)域,這些區(qū)域通常位于遠離它們所調(diào)節(jié)的基因的地方。
這種距離使得繪制基因和增強子之間復(fù)雜的相互作用圖譜變得困難。為了克服這個問題,麻省理工學院的研究人員發(fā)明了一種新技術(shù),使他們能夠觀察細胞中基因和增強子激活的時間。當一個基因與一個特定的增強子幾乎同時被激活時,它強烈表明該增強子控制著該基因。
在不同類型的細胞中,更多地了解哪些增強子控制哪些基因,可以幫助研究人員確定遺傳疾病的潛在藥物靶點。基因組研究已經(jīng)確定了許多與多種疾病有關(guān)的非蛋白質(zhì)編碼區(qū)域的突變。這些可能是未知的增強劑嗎?
“當人們開始使用基因技術(shù)來識別具有疾病信息的染色體區(qū)域時,大多數(shù)這些位點并不對應(yīng)于基因。我們懷疑它們對應(yīng)于這些增強子,這些增強子可能離啟動子很遠,所以能夠識別這些增強子是非常重要的,”麻省理工學院名譽教授、麻省理工學院科赫綜合癌癥研究所成員Phillip Sharp說。
Sharp是今天發(fā)表在《Nature》雜志上的這項新研究的資深作者。麻省理工學院研究助理D.B. Jay Mahat是該論文的主要作者。

圖1 單細胞新生RNA測序揭示協(xié)調(diào)的全球轉(zhuǎn)錄
尋找eRNA
不到2%的人類基因組是由蛋白質(zhì)編碼基因組成的。基因組的其余部分包括許多控制這些基因何時以及如何表達的元素。增強子被認為是在45年前發(fā)現(xiàn)的,它通過與基因啟動子區(qū)域的物理接觸,短暫地形成一個復(fù)合物,從而開啟基因。
最近,在2010年,研究人員發(fā)現(xiàn)這些增強子被轉(zhuǎn)錄成RNA分子,稱為增強子RNA或eRNA。科學家們懷疑,當增強子與靶基因積極相互作用時,這種轉(zhuǎn)錄就會發(fā)生。這就提出了一種可能性,即測量eRNA轉(zhuǎn)錄水平可以幫助研究人員確定增強子何時活躍,以及它針對哪些基因。
Mahat說:“這些信息對于理解細胞如何發(fā)育、理解癌癥如何改變它們的調(diào)控程序、激活導(dǎo)致去分化和轉(zhuǎn)移性生長的過程非常重要。”
然而,由于eRNA產(chǎn)生的數(shù)量非常少,并且在細胞中不能持續(xù)很長時間,因此這種繪制已被證明是困難的。此外,eRNA缺乏一種被稱為poly-A尾巴的修飾,這是大多數(shù)技術(shù)用來將RNA從細胞中拉出的“鉤子”。
捕獲eRNA的一種方法是向細胞中添加一個核苷酸,該核苷酸在與RNA結(jié)合時停止轉(zhuǎn)錄。這些核苷酸還含有一種叫做生物素的標簽,可以用來將RNA從細胞中撈出來。然而,目前的技術(shù)只適用于大量細胞,并不能提供單個細胞的信息。
在集思集想捕獲eRNA的新方法時,Mahat和Sharp考慮使用點擊化學,一種可以將兩個分子連接在一起的技術(shù),如果它們每個都被標記上可以一起反應(yīng)的“點擊手柄”。
研究人員設(shè)計了一鍵式手柄標記的核苷酸,一旦這些核苷酸被整合到生長的eRNA鏈中,這些鏈就可以用包含互補手柄的標簽打撈出來。這使得研究人員能夠捕獲eRNA,然后對其進行純化、擴增和測序。每一步都會丟失一些RNA,但Mahat估計他們可以成功地從一個給定的細胞中提取出大約10%的eRNA。

圖2 單細胞新生RNA測序的示意圖和基準
利用這項技術(shù),研究人員獲得了細胞中在給定時間內(nèi)活躍轉(zhuǎn)錄的增強子和基因的快照。
“你希望能夠確定,在每個細胞中,從調(diào)控元件和相應(yīng)基因的轉(zhuǎn)錄激活。這必須在單個細胞中完成,因為這是你可以檢測調(diào)節(jié)元件和基因之間的同步或異步的地方,”Mahat說。
基因表達的時機
研究人員在小鼠胚胎干細胞中展示了他們的技術(shù),他們發(fā)現(xiàn)他們可以根據(jù)RNA鏈的長度和聚合酶(負責轉(zhuǎn)錄的酶)的速度——也就是說,聚合酶每秒轉(zhuǎn)錄的距離——計算出特定區(qū)域開始轉(zhuǎn)錄的大致時間。這使他們能夠確定哪些基因和增強子在大約同一時間被轉(zhuǎn)錄。
研究人員使用這種方法比以前更詳細地確定細胞周期基因表達的時間。他們還能夠確認幾組已知的基因增強子對,并生成了一個大約5萬個可能的增強子基因?qū)Φ牧斜恚麄儸F(xiàn)在可以嘗試驗證這些基因?qū)Α?/div>
了解哪些增強子控制哪些基因,對于開發(fā)針對遺傳基礎(chǔ)疾病的新療法將證明是有價值的。去年,美國食品和藥物管理局(Food and Drug Administration)批準了首個治療鐮狀細胞性貧血的基因療法,該療法通過干擾一種增強劑來激活胎兒珠蛋白基因,從而減少鐮狀血細胞的產(chǎn)生。
麻省理工學院的研究小組現(xiàn)在正將這種方法應(yīng)用于其他類型的細胞,重點是自身免疫性疾病。他們正在與波士頓兒童醫(yī)院的研究人員合作,探索與狼瘡有關(guān)的免疫細胞突變,其中許多是在基因組的非編碼區(qū)域發(fā)現(xiàn)的。
“目前還不清楚哪些基因受到這些突變的影響,所以我們開始梳理這些假定的增強子可能調(diào)節(jié)的基因,以及這些增強子在哪些細胞類型中是活躍的,”Mahat說。“這是一個創(chuàng)建基因到增強子圖譜的工具,這是理解生物學的基礎(chǔ),也是理解疾病的基礎(chǔ)。”
這項研究的發(fā)現(xiàn)也為Sharp最近與麻省理工學院教授理查德·楊和Arup Chakraborty共同提出的一個理論提供了證據(jù),該理論認為基因轉(zhuǎn)錄是由被稱為冷凝物的無膜液滴控制的。這些凝聚物是由大量的酶和RNA組成的,Sharp認為其中可能包括在增強子位點產(chǎn)生的eRNA。
“我們認為增強子和啟動子之間的交流是一種凝聚型的瞬態(tài)結(jié)構(gòu),RNA是其中的一部分。這是一項重要的工作,有助于理解來自增強子的RNA是如何被激活的。
這項研究由美國國家癌癥研究所、美國國立衛(wèi)生研究院和祖母綠基金會博士后過渡獎資助。
參考資料
[1] Single-cell nascent RNA sequencing unveils coordinated global transcription



